精準醫(yī)療如何對抗癌癥?
時間:2017-09-11 09:49:58 來源:生物谷 點擊:
1. Ultrasound Med Biol:殺傷癌細胞的"精準"化療策略


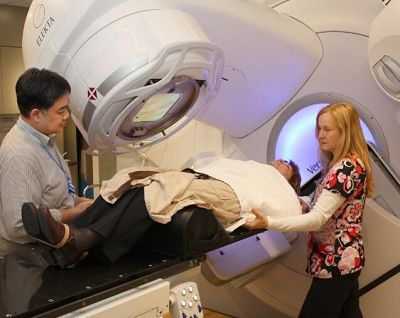



癌癥的治療,包括化療在內,能夠幫助很多患者延長壽命以及提高生活質量。然而化療也會對身體產生極大的副作用,這是由于化療藥物不僅能夠殺傷癌細胞,還會對自體的健康細胞進行攻擊。
而由于目前缺乏精確靶向癌細胞的療法,因此僅有0.01%的化療藥物能夠精確到達腫瘤組織進而殺傷。
最近,來自NTNU的研究者們開發(fā)出了一種新型的治療癌癥的精準療法,目前小鼠水平的試驗結果已經證明了該方法的可靠性。該文章的作者Sofie Snipstad博士稱:"超聲波能夠提高靶向乳腺癌細胞的納米顆粒包裹的藥物的運輸效果以及治療效果",相關結果發(fā)表在最近一期的《Ultrasound in Medicine and Biology》雜志上。
Snipstad的方法能夠將化療藥物靶向癌細胞,同時盡可能地不對健康細胞造成影響。目前該療法已經在三陰性乳腺癌小鼠模型中進行了炎癥。
與直接將藥物注入血液不同,該方法選擇了將藥物包裹在納米顆粒中。由于體積較大,這些顆粒在健康的組織周圍只能停留在血管中,進而避免了其對健康細胞的傷害、而在腫瘤組織中,由于血管有很多孔狀結構,因此納米顆粒能夠輕易地穿過血管進入組織。不過,由于納米顆粒僅能夠將藥物運送到靠近血管的腫瘤組織,因此那些遠離血管的腫瘤細胞無法受到藥物的影響。
特別地,這些納米顆粒能夠形成微泡,而顆粒本身處于微泡的表面。當注入血液中之后,超聲波將引導其破裂,從而能夠幫助納米顆粒的釋放。這種"爆破"還能夠導致血管出現更多的穿孔,進而方便藥物進入腫瘤組織內部。
試驗結果表明,上述方法向腫瘤組織中運輸的有效藥物濃度是常規(guī)方法的250倍,而且接受這種治療方法的小鼠腫瘤的生長受到了更為明顯的遏制??傊@一技術為癌癥的化學治療提供了新的藥物運送策略。

一項新的生物醫(yī)學工具能夠利用納米顆粒運送基因到達靶細胞中,從而方便解決多種疾病,包括癌癥、糖尿病以及HIV,這種方法相比傳統(tǒng)的治療手段更加快速、廉價以及便捷。
這一工具是由來自Fred Hutchinson癌癥中心的研究者們開發(fā)出的。相關的前臨床試驗結果發(fā)表在最近一期的《Nature Communications》雜志上。
"我們的目標是將基于細胞的治療手段變得更加簡單化",該文章的作者,來自Fred Hutch 臨床部門的生物材料學專家Matthias Stephan說道:"在這項研究中,我們開發(fā)出了一種新的產品,只需要將培養(yǎng)的細胞放進去就就能夠達到治療效果,而不需要任何其它的操作"。
Stephan等人開發(fā)的這種基于納米顆粒的藥物運輸系統(tǒng),能夠擴大mRNA的治療潛能,即能夠將RNA直接運送到機體的細胞中,從而指導機體編碼蛋白質抵抗疾病的發(fā)生。通過運送mRNA進行遺傳調控,能夠起到短期范圍內的基因表達特征的改變,這種方式不會改變細胞中原有的遺傳信息,從而避免對機體產生不可避免的影響。
Stephan等人利用三個例子證明其技術的可靠性:
首先,利用納米顆粒攜帶T細胞基因編輯工具,從而對天然的T細胞受體進行改造,之后將其與編碼"嵌合抗原受體(CAR)"的基因聯合使用,從而使改造后的T細胞能夠靶向腫瘤細胞發(fā)起攻擊。
其次,納米顆粒攜帶能夠促進造血干細胞復制的mRNA,從而加快造血干細胞增殖的速率,并且通過骨髓移植的方式替換體內原有的癌細胞。
第三,納米顆粒攜帶能夠改造CAR-T細胞的mRNA以及foxo1mRNA,從而使得抗癌T細胞產生"記憶"能力,最終形成長期的抗癌屬性。
目前這項技術僅僅在實驗室水平得到了檢驗,并不一定適用于臨床實踐,但Stephan目前正在尋找商業(yè)伙伴,以促進該技術在臨床中的應用。
doi: 10.7554/eLife.23421

精準醫(yī)療如今越來越成為癌癥療法的創(chuàng)新性領域了,研究人員往往會對用普通藥物進行治療的患者進行靶向特殊腫瘤和分子的治療,盡管目前研究者已經在靶向癌癥療法領域看到了進展,但未來仍然還有很長一段路要走;近日來自莫菲特癌癥研究中心及達納-法伯癌癥研究所的研究人員利用非侵入性的方法評估肺部腫瘤的分子和臨床特性,闡明了放射組學在改善精準化治療上的潛力和作用,相關研究刊登于國際雜志eLife上。
放射組學能夠為很多科學家及臨床研究者提供新的方法來分析單個腫瘤的特性,從而指導癌癥療法,并且預測患者對療法的反應;研究人員會通過多種方法對癌癥患者的腫瘤進行成像,這些方法包括電腦斷層掃描(CT)、磁共振(MRI)、正電子成象術(PET)等,腫瘤圖像就能夠幫助臨床醫(yī)生確定患者腫瘤的位置和階段,從而指導療法決策。這些圖像或許能夠用于放射組學領域來提取出高維數據幫助指導更為精準化的治療;研究人員就能夠利用放射組學來對腫瘤的不同特性進行定量,比如形狀、尺寸、質地等,隨后這些數據也能夠同患者的遺傳及臨床數據結合幫助研究者更好地預測患者的臨床預后及潛在的治療手段如何對患者進行治療。
研究者Robert Gillies博士表示,放射組學的核心理念就是圖像并不是圖片,而是數據;如今我們提取出了大約1300種不同的定量特性數據;研究人員隨后對262名非小細胞肺癌的北美患者以及89名歐洲患者進行研究,分析患者的CT圖像特性,隨后研究者鑒別出了圖像特性、分子標志物、生物學途徑以及患者臨床預后之間的關聯;研究者表示,放射組學算法具有較強的臨床重要性。
在指導精準化治療上放射組學具有多種優(yōu)勢,目前研究者會侵入性地提取組織樣本來分析生物標志物的特性,但常常這并不能準確反映整個腫瘤的生物學特性;相比較而言,成像技術卻是非侵入性的,而且能夠通過整個的治療和反應過程來向研究者提供完整腫瘤的信息;此外,大部分的癌癥患者通常都會進行用于診斷目的的圖像,這就使得放射組學成為了一種成本效益的方法。
最后研究者Gillies表示,本文研究或能加速科學家們利用放射組學進行腫瘤特性的研究步伐,隨著成像技術慢慢成為臨床實踐中的常規(guī)治療標準,本文研究也將會為研究者提供新的機會來幫助改善患者的精準化治療。
doi:10.1038/nature23306

在一項新的研究中,來自美國密歇根大學、斯隆凱特林癌癥紀念中心和霍華德-休斯醫(yī)學研究所的研究人員發(fā)現,平均而言,轉移性癌癥具有的基因突變比在早期階段的腫瘤中觀察到的更多。相關研究結果于2017年8月2日在線發(fā)表在Nature期刊上,論文標題為"Integrative clinical genomics of metastatic cancer"。
這意味著為了使得精準醫(yī)療在癌癥治療中成為現實,你需要一種實時的綜合方法來詳細地研究轉移性腫瘤和轉移步驟。這種詳細程度是最為常見的測試方法所不能夠達到的。
作為對晚期癌癥的基因特征和分子特征開展的最大規(guī)模和最為綜合的研究之一,這些研究人員對500名轉移性癌癥患者的DNA和RNA進行測序。
這項研究的獨特之處在于:(1)研究人員獲得大多數患者的新鮮活組織,而且是從轉移性腫瘤而不是從原發(fā)性腫瘤中提取樣品;(2)他們對DNA和RNA進行測序;(3)他們對癌變組織的DNA與患者正常組織的DNA進行比較。
論文通信作者、密歇根大學轉化病理學中心主任Arul Chinnaiyan博士說,"這種方法比大多數商業(yè)上獲得的臨床測序方法更加全面。我們的結果表明這種更加詳細的方法在多種水平上都具有價值。"
這些數據反映了首批參與密歇根腫瘤學測序項目(Michigan Oncology Sequencing Program)的500名實體瘤患者。密歇根腫瘤學測序項目開始于2010年,對轉移性癌癥和正常組織的DNA和RNA進行測序以便鑒定出可能有助促進療法開發(fā)的變化。該項目包括一個精準醫(yī)療腫瘤委員會,在這個委員會中,專家們討論每個病例。Mi-ONCOSEQ是給癌癥患者提供的首批綜合臨床測序項目之一。
這些患者涉及30多種癌癥,并且腫瘤轉移到22種不同的器官。盡管Mi-ONCOSEQ也適用于血癌患者和兒童患者,但是在這項新的研究中,它僅包括成年實體瘤患者。
對轉移性腫瘤而不是對原發(fā)性腫瘤進行活組織取樣
這些研究人員發(fā)現相比于患者的原發(fā)性癌癥,在轉移性癌癥中發(fā)生的突變數量和類型顯著增加。他們發(fā)現幾乎每個轉移性癌癥病例含有更多的突變。這可能反映了轉移性癌癥更具侵襲性:轉移性癌癥有更多的機會產生進一步的突變,而且旨在殺死它們的療法會導致更多的突變。
Chinnaiyan說,"我們的發(fā)現強調獲得轉移性腫瘤的新鮮活組織樣品是比較重要的。腫瘤通過進化發(fā)生轉移,需要接受治療。我們需要獲得轉移性腫瘤的活組織,隨后給出治療建議,而不是利用來自原發(fā)性腫瘤的組織給出這樣的建議。"
RNA測序揭示出更多的靶標
另一個關鍵的組成部分是對RNA和DNA進行測序。這種具有更加廣泛應用的方法揭示出許多分子在腫瘤微環(huán)境中發(fā)揮著作用,促進和允許癌癥繼續(xù)生長、擴散或躲避治療。
一般而言,大多數臨床測序研究僅聚焦于DNA測序。盡管DNA測序揭示出參與轉移性癌癥的基因變化,但是這些研究人員發(fā)現RNA測序闡明了激活致癌基因或關閉阻止癌癥產生的基因的內在機制。他們的發(fā)現可能有助鑒定出潛在的治療靶標。
此外,通過研究RNA,這些研究人員能夠研究腫瘤微環(huán)境中的免疫細胞,這會給為何免疫療法可能僅適合治療一些患者但不適合治療其他患者提供線索。
Chinnaiyan說,"理解免疫微環(huán)境(immune microenvironment)---浸潤到腫瘤中的細胞類型和它們正在表達哪些基因----是比較重要的。它讓我們了解免疫表型(immuno-phenotype)。我們猜測我們可能利用這一點協(xié)助確定哪些患者對免疫療法作出反應。"不過,在這個領域還需開展更多的研究。
另一個關鍵發(fā)現是轉移性腫瘤表現出兩個相互排斥的特征之一。一種特征是高度增殖,這意味著它侵襲性地增殖。在另一種特征中,細胞通過上皮-間質轉化(epithelial to mesenchymal transition, EMT)喪失了分化能力。
Chinnaiyan說,"并不是所有轉移性腫瘤都是一樣的。不同的通路促進它們存在非常大的差異---是高度增殖還是發(fā)生更多的分化。這種相互排斥的性質是一項驚人的發(fā)現,這可能指導我們開發(fā)新的療法。"
發(fā)現遺傳性突變
還有一項驚人的發(fā)現是12%的轉移性癌癥患者攜帶遺傳性突變。這大約是在所有癌癥患者中可能期待的四倍。這些突變是通過比較腫瘤DNA和正常組織的DNA而被鑒定出的。
大約四分之三的這些突變與DNA修復過程相關聯,而且?guī)追N現存的療法旨在靶向這種DNA修復過程。
Chinnaiyan說,"在轉移性癌癥患者中,這種遺傳性突變發(fā)生率是比較高的。一旦鑒定出這些突變,那么這些患者家庭中的其他人可能也攜帶這些突變,并且具有更高的癌癥發(fā)生風險。"
在適當的情形下,家庭成員可能尋求遺傳咨詢或進一步的篩選。參與Mi-ONCOSEQ項目的患者接受了遺傳咨詢,而且如果存在遺傳性突變,那么這種遺傳咨詢就應擴展到這些患者的家庭。
這些研究人員當前正在分析這首批患者的治療結果。今年早些時候在美國臨床腫瘤學會年度會議上發(fā)布的初步數據提示著在四分之三的患者當中,他們的腫瘤經測序后具有"可靶向的突變(actionable mutation)",這意味著存在靶向這種突變的療法。迄今為止,總共有將近2300名患者參與Mi-ONCOSEQ項目。

近日,來自哥德堡大學的研究人員通過研究開發(fā)了一種新方法來更精準地檢測抗癌藥物的作用效果,這種方法或為后期研究人員對特殊藥物治療疾病療效的評估提供了新的希望。
研究者Berglind Osk Einarsdottir博士表示,對于癌癥患者而言,一些處方藥通常無法治療其疾病,而且還會產生一定的副作用;但我們開發(fā)的新方法或許能夠早期地在藥物開發(fā)階段中使用,來幫助確定哪類患者會因藥物而獲益。這種方法能夠鑒別出是否癌癥患者會因特殊療法而獲益,而這是基于外科手術過程中患者腫瘤組織的活組織檢查結果。
這項研究中,研究者在動物模型中追蹤腫瘤的生長,同時還檢測了動物模型對不同癌癥藥物的反應,整個實驗基于腫瘤的生長速率,會花費數周至數月時間。這種新方法目前并未在瑞典醫(yī)療系統(tǒng)中使用,但研究人員能夠進行相關實驗來闡明該方法是否能夠發(fā)揮作用以及未來患者是否需要利用這種方法進行疾病的治療。
在一項子研究中,研究者揭示了33名癌癥患者對抗癌制劑Karonudib的反應機制,Karonudib是最近卡羅琳學院開發(fā)的一種新型制劑。研究結果表明,三分之二的患者樣本都能夠對療法產生反應;但問題在于,這些患者之間是否存在一些共通之處,比如DNA、機體代謝、蛋白表達等等;相關的研究結果或能幫助研究者更好地預測在哪類患者中藥物能夠真正抑制其機體的腫瘤,并且對癌細胞進行殺滅。
研究者指出,這或許與組織中所發(fā)現的突變并沒有什么關系,他們所看到的或許也只是一種方式,即腫瘤對療法會產生耐受性;當然有些腫瘤樣本中蛋白的表達水平較高,其能夠幫助細胞排斥藥物的攻擊作用,當然這或許也是一種癌細胞所產生的一種耐受性機制。最后研究者說道,未來我們或許有望利用這種新方法以患者為導向,來鑒別哪種抗癌藥物能夠給特殊患者帶來最大藥效;或許也可以以藥物開發(fā)為導向,幫助鑒別哪類患者會因特殊的抗癌藥物而獲益,當然這都需要后期研究人員更為深入的研究才能夠實現。
doi: 10.1038/leu.2017.93.

近日,來自意大利的科學家在自然旗下期刊Leukemia上發(fā)表了一項最新研究進展,他們發(fā)現一種組蛋白去乙酰化酶抑制劑能夠選擇性殺傷發(fā)生某個基因重排的B前體細胞急性淋巴細胞白血?。˙CP-ALL),該研究為這種難治白血病亞型的治療提供了新的潛在藥物。
攜帶CRLF2和JAK2基因變異的白血病細胞存在JAK/STAT信號途徑的異常,并且病人往往預后情況不好。HDAC抑制劑givinostat/ITF2357能夠通過抑制JAK/STAT途徑在全身型幼年特發(fā)性關節(jié)炎和骨髓增殖性腫瘤的治療方面發(fā)揮作用。這些發(fā)現讓研究人員意識到givinostat這種藥物可能對發(fā)生CRLF2重排的BCP-ALL也有作用,目前這種白血病還沒有有效的治療方法。
在這項研究中,研究人員發(fā)現givinostat能夠抑制發(fā)生CRLF2重排的BCP-ALL細胞系的增殖,并誘導細胞凋亡。與之類似,givinostat還可以殺死發(fā)生CRLF2重排的病人體內的白血病細胞,但是對正常的造血細胞沒有影響。研究人員還發(fā)現在低劑量情況下,givinostat能夠下調JAK/STAT信號途徑中的基因表達,抑制STAT5的磷酸化。
研究人員在在體內實驗中觀察到givinostat能夠顯著抑制人源化腫瘤異種移植模型體內腫瘤的生長。重要的是,givinostat能夠殺死抵抗ruxolitinib的細胞,增強目前所使用的化療藥物的作用效果。因此givinostat與傳統(tǒng)化療藥物聯合或代表了治療這種難治白血病亞型的一種有效方法。最后,givinostat對癌細胞的選擇性殺傷作用能夠有助于降低藥物強度,降低毒性和相關并發(fā)癥。
綜上所述,該研究發(fā)現givinostat這種HDAC抑制劑對發(fā)生CRLF2基因重排的BCP-ALL有選擇性殺傷作用,為該疾病治療找到一種潛在藥物。
DOI:10.1016/j.ccell.2017.02.017

在最近發(fā)表在國際學術期刊Cancer Cell上的一項新研究中,來自密歇根大學的研究人員開發(fā)了一種新治療策略,可以靶向大約一半前列腺癌中都會發(fā)生的基因變異。
當TMPRSS2和ERG這兩個基因在染色體上發(fā)生重定位并且融合在一起,就會開啟前列腺癌發(fā)育。但是開發(fā)靶向ERG的小分子抑制劑一直存在很大挑戰(zhàn)性。
在這項研究中,研究人員利用大分子多肽來靶向ERG,他們在細胞系和動物模型中證明這種方法可以有效靶向并促進ERG融合蛋白的降解,對細胞正常功能幾乎不會產生影響。
"靶向這個融合基因的表達產物是一個很大的挑戰(zhàn)。我們從另外一個角度解決了這一問題。"文章作者Arul M. Chinnaiyan這樣說道。
研究人員發(fā)現了一組多肽能夠與ERG蛋白發(fā)生特異性相互作用。他們在能夠產生融合基因產物的細胞系上檢測了這組多肽,發(fā)現可以破壞ERG功能。在不產生這種融合基因產物的細胞中,這些多肽幾乎不會對基因表達產生影響。他們還研究了這些多肽如何影響ERG調控的生物學過程。
但是研究人員面臨的其中一個難題就是這些多肽降解得很快,持續(xù)時間不夠長無法到達指定部位。因此研究人員開發(fā)了一些多肽類似物來解決正常多肽的降解問題,這些多肽類似物持續(xù)的時間可以更長。
研究人員還在動物模型上對這些多肽類似物進行了檢測,結果表明這些多肽類似物能夠抑制獲得ERG融合蛋白的前列腺腫瘤的生長。在延長治療時間之后,超過三分之一的小鼠腫瘤在一月后沒有出現復發(fā)跡象。
"這是進行前列腺癌精準治療的一個很好的例子:只有出現ERG基因融合的病人才適合這種藥物。而ERG融合蛋白在前列腺癌中非常常見,因此這類藥物一定會大放異彩。"Chinnaiyan這樣說道。
這種多肽方法的一個弊端就是這樣的大分子無法直接穿過細胞膜,這就意味著這些多肽還需要經過某種修飾或者通過某種運輸方法來通過細胞膜。由于小分子藥物能夠輕易進入細胞并與靶點結合,因此在藥物開發(fā)中比較受青睞。
研究人員接下來將會進一步分析這些多肽與ERG融合蛋白結合的三維結構,希望能夠將這類分子進一步開發(fā)成抑制ERG的小分子。與此同時他們還將繼續(xù)研究如何將多肽類似物做得更好。



